Sujet : IMA
LumiraDx obtient le marquage CE pour le test de l'antigène COVID-19 sur Amira, son nouveau système de test à faible coût
- Système de test antigénique nouvelle génération reposant sur plus de huit années de recherche et soutenu par les meilleurs experts en microfluidique du secteur
- Le système Amira comprend l'analyseur Amira, les bandes de test SARS-CoV-2 Ag Amira, les écouvillons et le matériel de préparation des échantillons
- Conçu pour offrir des performances comparables à celles d'un laboratoire à un prix comparable à celui d'un flux latéral
LONDRES, 10 juin 2022 /PRNewswire/ -- LumiraDx Limited (Nasdaq: LMDX), une société de diagnostic de nouvelle génération au point de service, a annoncé aujourd'hui qu'elle avait obtenu le marquage CE pour le système Amira, son nouveau système de test qui permet de réaliser des tests COVID-19 à faible coût et très sensibles. L'analyseur Amira lit les bandelettes réactives SARS-CoV-2 Ag Amira incluses et renvoie un résultat en 15 minutes seulement. L'analyseur Amira condense la technologie des grands analyseurs de laboratoire en un instrument portable, dont la taille et le poids sont comparables à ceux d'un jeu de cartes, et qui fournit des tests très performants en quelques minutes. La marque CE initiale pour le système Amira couvre l'utilisation professionnelle sur le lieu de soins. Cependant, la société prévoit de demander des approbations et autorisations réglementaires supplémentaires pour le système Amira, y compris celles requises pour une utilisation non professionnelle, en vente libre, afin d'offrir une valeur ajoutée pour les tests à domicile, lors d'événements, sur le lieu de travail et en voyage.
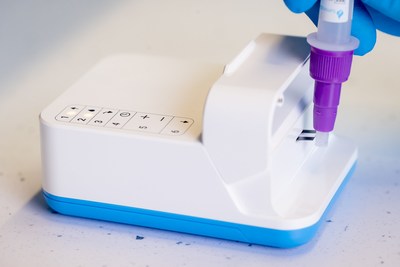
La technologie microfluidique du test SARS-CoV-2 Ag Amira offre d'excellentes performances de test Le test présente un pourcentage positif de 90,00% et un pourcentage négatif de 99,31 % par rapport à la RT-PCR chez les individus symptomatiques, selon les données cliniques recueillies de 0 à 10 jours depuis l'apparition des symptômes. Au sein de cette cohorte, le test SARS-CoV-2 Ag Amira a montré une sensibilité de 95,6 % jusqu'à une valeur CT de 30, ce qui indique une couverture élevée de personnes potentiellement infectieuses.
Ron Zwanziger, directeur général de LumiraDx, a déclaré : « Le système Amira apporte une combinaison unique de caractéristiques sur le marché. C'est l'une des seules solutions de test de la COVID-19 sur le marché qui peut offrir des résultats très précis, lus objectivement, avec le délai d'exécution rapide et le faible prix de nombreux tests de flux latéral. Les tests fréquents font désormais partie de la vie de beaucoup d'entre nous afin de limiter la propagation du virus. Cependant, en l'absence de résultats fiables, de nombreux protocoles de test ne permettent pas de protéger avec précision les patients, les employés et les familles. »
Le système Amira sera prochainement commercialisé en Europe sous la forme d'un kit de démarrage comprenant un analyseur et 200 bandelettes de test SARS CoV-2 Ag Amira.
LumiraDx (Nasdaq: LMDX) est une entreprise de diagnostic au point d'intervention de nouvelle génération qui transforme les soins de santé communautaires. Fondée en 2014, LumiraDx fabrique et commercialise une plateforme de diagnostic innovante qui prend en charge un large menu de tests avec des performances comparables à celles des laboratoires au point de soins. Les solutions de test de diagnostic LumiraDx sont déployées par les gouvernements et les principaux établissements de santé dans les laboratoires, les services d'urgence, les cabinets médicaux, les pharmacies, les écoles et les lieux de travail pour dépister, diagnostiquer et surveiller le bien-être et les maladies. LumiraDx a, sur le marché et en développement, plus de 30 tests couvrant les maladies infectieuses, les maladies cardiovasculaires, le diabète et les troubles de la coagulation, le tout sur la plateforme LumiraDx. De plus, LumiraDx dispose d'un portefeuille complet de solutions de dépistage de la COVID-19 rapides, précises et économiques, du laboratoire au lieu du besoin.
LumiraDx est basé au Royaume-Uni avec plus de 1 600 employés dans le monde entier. De plus amples renseignements sur LumiraDx sont disponibles sur : www.lumiradx.com
Ce communiqué de presse contient des déclarations prospectives au sens de la loi américaine Private Securities Litigation Reform Act de 1995, y compris des déclarations concernant les performances et les avantages du système Amira, la possibilité de demander des approbations et des autorisations réglementaires supplémentaires pour le système Amira, et le calendrier de commercialisation prévu pour le système Amira. Ces déclarations impliquent des risques, des incertitudes et d'autres facteurs qui peuvent faire en sorte que les résultats réels, les niveaux d'activité, les performances ou les réalisations soient sensiblement différents des informations exprimées ou sous-entendues par ces déclarations prospectives, y compris, mais sans s'y limiter, les conditions économiques, politiques et commerciales générales ; les changements réglementaires ; la capacité de LumiraDx à maintenir le marquage CE de son analyseur Amira et de son test SARS-CoV-2 Ag ; et les facteurs abordés sous le titre « Facteurs de risque » dans le rapport annuel sur le formulaire 20-F pour l'année se terminant le 31 décembre 2021, qui a été déposé par LumiraDx auprès de la Securities and Exchange Commission (« SEC ») le 13 avril 2022, et dans d'autres dépôts effectués par LumiraDx auprès de la SEC. Bien que LumiraDx pense disposer d'une base raisonnable pour chaque déclaration prospective contenue dans ce communiqué de presse, LumiraDx vous avertit que ces déclarations sont basées sur une combinaison de faits et de facteurs actuellement connus par elle et sur ses projections d'avenir, dont elle ne peut être certaine. LumiraDx ne s'engage pas à mettre à jour ou à réviser les informations contenues dans ce communiqué de presse, que ce soit à la suite de nouvelles informations, d'événements ou de circonstances futurs ou autres, sauf si la loi applicable l'exige.
Contact pour les médias :
[email protected]
Contact commercial :
[email protected]
Photo : https://mma.prnewswire.com/media/1836100/AmiraImage.jpg
Ces communiqués peuvent vous intéresser aussi
|
Communiqué envoyé le et diffusé par :



